
题目列表(包括答案和解析)
(14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
第一组
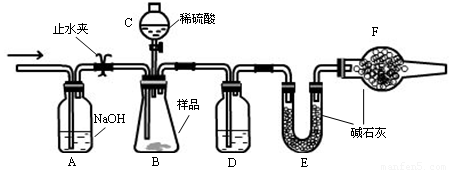
实验装置
实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称 ,D中盛放的试剂是 。
(2)B中发生反应的化学方程式为 。
(3)A中反应的离子方程式为 。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是 (选填字母)
A.实验后期不通入空气 B.将仪器C中的硫酸换成盐酸
C.撤走仪器D D.撤走仪器F
第二组
实验装置
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
(1) 检查该装置气密性的方法是: 。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为 (填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为 。
(14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
第一组
实验装置
实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称 ,D中盛放的试剂是 。
(2)B中发生反应的化学方程式为 。
(3)A中反应的离子方程式为 。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是 (选填字母)
A.实验后期不通入空气 B.将仪器C中的硫酸换成盐酸
C.撤走仪器D D.撤走仪器F
第二组
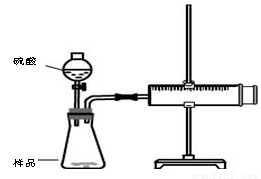
实验装置
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
(1) 检查该装置气密性的方法是: 。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为 (填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为 。
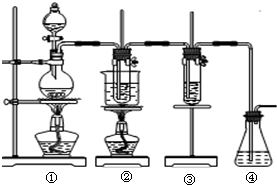
 在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
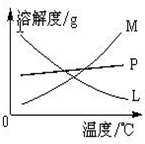
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白: 图中符合该晶体溶解度曲线的是
图中符合该晶体溶解度曲线的是| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红色 红色 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为 浅黄绿色 浅黄绿色 色 |
过量氯气溶解于水中 过量氯气溶解于水中 |
 在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白: 图中符合该晶体溶解度曲线的是______(填写编
图中符合该晶体溶解度曲线的是______(填写编| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com