
题目列表(包括答案和解析)
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
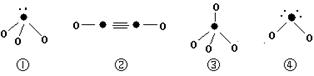
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |

| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |

A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com