
题目列表(包括答案和解析)
下列能证明某溶液一定呈酸性的是:
A.溶液中c(H+)>10¯7mol•L¯1 B.溶液的PH<7
C.溶液中c(OH¯)<c(H+) D.滴入酚酞试剂呈无色
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |

| 2 | 3 |
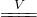 Cu2S(黑色)
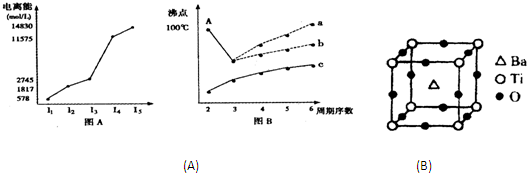
Cu2S(黑色)| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子气态分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |





湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com