
题目列表(包括答案和解析)
 确定物质性质的重要因素是物质结构.请回答下列问题.
确定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ?mol-1 | 715 | 3791 | 3401 |
| C | 2- 2 |
| O | 2+ 2 |
| O | 2+ 2 |


| O | 2+ 2 |
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
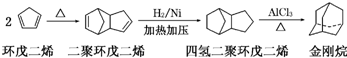
 +Br2→
+Br2→ 或
或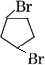
 +Br2→
+Br2→ 或
或
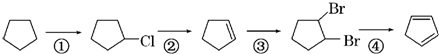
 +Cl2
+Cl2| 光照 |

 +Cl2
+Cl2| 光照 |

 +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr
+2NaBr +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr
+2NaBr )和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料
)和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料 .
.



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com