
题目列表(包括答案和解析)
 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)
氨是重要的氮肥,合成原理为:N2(g)+3H2(g) | 高压 |
| 催化剂 |
| C2(NH3) |
| C(N2)C3(H2) |
| C2(NH3) |
| C(N2)C3(H2) |
(
| ||||
(
|
(
| ||||
(
|
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
| A.采用较高压强 |
| B.采用500 ℃的高温 |
| C.用铁触媒作催化剂 |
| D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔 |

氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
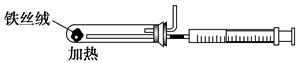
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
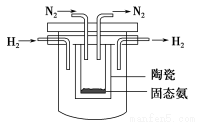
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1| A.采用较高压强 |
| B.采用500 ℃的高温 |
| C.用铁触媒作催化剂 |
| D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔 |

(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是__________(填字母)。
A采用较高压强(20—50 MPa)
B采用500 ℃的高温
C用铁触媒作催化剂
D将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
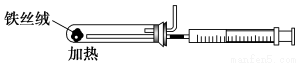
(2)下图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法:______________________________________________________。
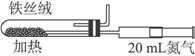
(3)在298 K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924 kJ?
___________________________________________________________________。
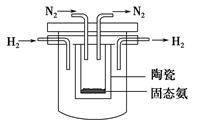
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
阴极的电极反应式为:__________________________________________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com