Ⅰ以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工业.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H
2O(g)

CO(g)+H
2(g)△H=+131.3kJ?mol
-1,
该反应在常温下
不能
不能
自发进行(填“能”与“不能”);在一体积为2L的密闭容器中,加入1molC和2mol H
2O(g),达平衡时H
2O的转化率为20%,请计算此时的平衡常数
0.05
0.05
(2)目前工业上有一种方法是用CO与H
2反应来生产甲醇.
| 化学键 |
C-O |
C-H |
H-H |
C≡O |
O-H |
| 键能 kg/mol-1 |
358 |
413 |
436 |
1072 |
463 |
已知生成气态甲醇,CO里面含C≡O.请写出该反应的热化学方程式为
CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N
2(g)+3H
2(g)

2NH
3(g)△H=-92.4kJ/mol
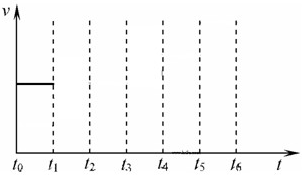
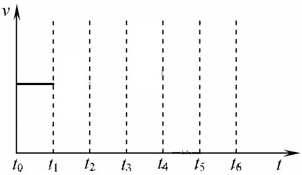
在一体积不变的容器中,当合成氨反应达到平衡后,在t
1时升高温度,t
2重新达到平衡,t
3时充入氮气,t
4时重新达到平衡,t
5时移去一部分产物,t
6时又达到平衡,请在下面的反应速率与时间关系图中画出t
1到t
5逆反应速率、t
5到t
6正反应速率的变化情况.
(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O
2-.则通丙烷的电极发生的电极反应为
C3H8+10O2--20e-=3CO2+4H2O
C3H8+10O2--20e-=3CO2+4H2O
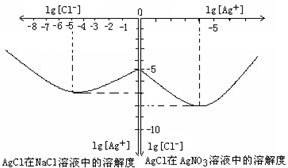
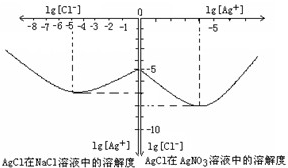
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl
-=[AgCl
2]
-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
10-12
10-12
.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了.
开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了.
.

 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1, 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol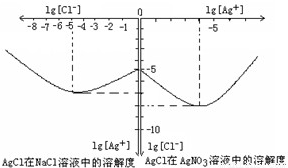


 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1, 2NH3(g)△H=-92.4kJ/mol
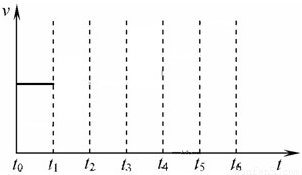
2NH3(g)△H=-92.4kJ/mol 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.