已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH
3COOH溶液中存在电离平衡:
CH
3COOH?CH
3COO
-+H
+△H>0.
(1)常温下,在 pH=5的稀醋酸溶液中,c(CH
3COO
-)=
(10-5-10-9)mol/L
(10-5-10-9)mol/L
(列式,不必化简);下列方法中,可以使0.10mol?L
-1 CH
3COOH的电离程度增大的是
bcf
bcf
?
a.加入少量0.10mol?L
-1的稀盐酸 b.加热CH
3COOH溶液
c.加水稀释至0.010mol?L
-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L
-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
<
<
V(醋酸),反应的最初速率为:v(盐酸)
=
=
v(醋酸).(填写“>”、“<”或“=”)
(3)常温下,向体积为V
a mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液V
b mL至溶液恰好呈中性,则V
a与V
b的关系是:
Va<Vb
Va<Vb
.
(4)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为
c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)
c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)
.
(5)已知:90℃时,水的离子积常数为K
w=3.8×10
-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H
+)=
2.05×10-11
2.05×10-11
(保留三位有效数字)mol/L.

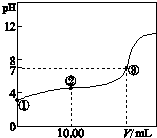 常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示.
常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示.