
题目列表(包括答案和解析)
某化学课外活动小组用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,正反应为放热反应,温度稍高即发生副反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O.甲、乙、丙三人分别设计三个实验装置,如下图所示.
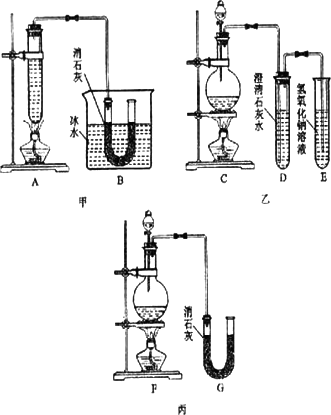
(1)请指出三个装置各处的缺点或错误(如没有可不填)
甲:________;
乙:________;
丙:________.
(2)图甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号)________.
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15 mol,其可能的主要原因是(假定各步反应均无反应物损耗且无副反应发生)________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com