
题目列表(包括答案和解析)
(1)根据以上叙述判断,所涉及的三种酸中,属于弱酸的是_________,判断理由是_________
_________________________________________________________________。
(2)在某反应体系中,只有高碘酸、硫酸锰、硫酸、碘酸、高锰酸和水,且反应过程中高碘酸作氧化剂,试写出该体系中发生反应的化学方程式___________________________;若该反应恰好反应完全且有0.1 mol电子发生转移,反应后溶液体积为100 mL,则所得溶液中c(H+)=__________________。
(共8分)
Ⅰ.(2分)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol?L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)(6分)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是 (填化学式)。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
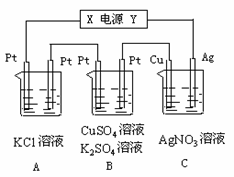 试回答:
试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________________,
B池________________,
C池________________。
⑶ 写出B池中所发生的电解反应方程式:
_____________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com