
题目列表(包括答案和解析)
用0.1mol?L-1 NaOH溶液滴定100mL 0.1mol?L-1盐酸,若滴定误差在±0.1%以内,反应完毕后,溶液pH的范围为
A、3.3~10.7 B、4.3~9.7 C、5.3~8.7 D、6~8

将0.1 mol的镁、铝混合物溶于100mL 2mol·L![]() 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L![]() 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)
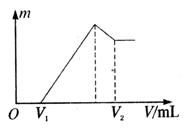
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中
mL时,则金属粉末中![]() (Mg)= mol,
(Mg)= mol,![]() mL。
mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
将0.1 mol的镁、铝混合物溶于100mL 2mol·L![]() 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L![]() 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中
mL时,则金属粉末中![]() (Mg)= mol,
(Mg)= mol,![]() mL。
mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
将0.1 mol的镁、铝混合物溶于100mL 2mol·L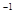 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L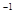 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)

(1)若在滴加NaOH溶液的过程中沉淀质量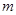 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当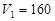 mL时,则金属粉末中
mL时,则金属粉末中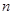 (Mg)= mol,
(Mg)= mol,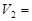 mL。
mL。
(2)①要配制100 mL 2mol·L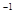 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com