
题目列表(包括答案和解析)
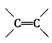 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。①广泛用作农用薄膜的聚氯乙烯塑料,是由
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。①广泛用作农用薄膜的聚氯乙烯塑料,是由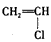 聚合而成的,其聚合的化学方程式是__________________________。 ②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯
聚合而成的,其聚合的化学方程式是__________________________。 ②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯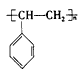 它是由_____________________(写结构简式)聚合而成的。
它是由_____________________(写结构简式)聚合而成的。
| ||
| ||
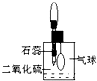 生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为
生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为
在有机化合物中,由于基团之间的相互影响,会使有机分子中相关原子或原子团的反应活性发生显著变化.
(1)同样以羟基(-OH)为官能团,乙醇为中性,苯酚却表现弱出酸性,请你另起一例,说明基团之间相互作用对物质化学性质的影响:
________________________________,
(2)实验表明,丙酸分子中“-CH2-”上的碳氢键因与“-COOH”相邻,反应活性明显增强.比如,在红磷存在时,丙酸可与液溴发生取代反应生成2-溴丙酸(CH3CHBrCOOH)请写出该反应的化学方程式________________________.
(3)已知含有“![]() ”结构的有机物不能稳定存在.请结合(1)、(2)有关信息,分析如下转化关系,回答问题:
”结构的有机物不能稳定存在.请结合(1)、(2)有关信息,分析如下转化关系,回答问题:
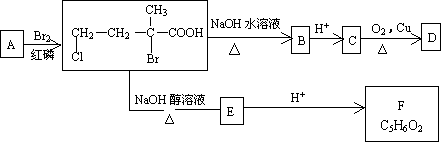
①A的结构简式为________.D中所含官能团的名称是________.
②C→D的化学方程式为________.
③D不可能发生的反应是________(填字母代号)
A.水解反应 b.消去反应 c.银镜反应 d.酯化反应 e.加成反应 f.还原反应 g.氧化反应
④F有多种同分异构体,其中含有![]() 两种官能团,且分子结构中只含一个甲基的有机物共有________种,写出其中一种的结构简式______________.
两种官能团,且分子结构中只含一个甲基的有机物共有________种,写出其中一种的结构简式______________.
 合成
合成 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).




 ,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式:
,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式:

 的化学方程式(有机物写结构简式,注明反应条件).
的化学方程式(有机物写结构简式,注明反应条件).

 ,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是
,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是 B.
B. C.
C. D.
D.
2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了“泛素调节下的蛋白质降解”。人的很多疾病就是这一降解过程不正常导致的。
(1)泛素是由一种76个氨基酸组成的多肽,就像标签一样,无用的蛋白质就被这种“死亡之吻”物质粘贴,被运送到细胞内的“垃圾处理厂”,在细胞E1、E2和E3三种酶激活、辨认和捆绑下,经过蛋白酶体的处理,蛋白质就被切成由7至9个氨基酸组成的短链。根据以上信息,下列说法正确的是( )
A.人体合成的蛋白质在细胞内降解与人食用的蛋白质在胃中降解产物完全相同
B.E1、E2和E3三种酶都属于蛋白质
C.酶具有专一性、高效性等
D.76个氨基酸分子形成的链状泛素分子中最多有76个肽键
(2)蛋白质的降解是一个复杂的过程,一个具有抗菌性质的多肽,短杆菌肽S,它的结构如下图所示:

已知甘氨酸与丙氨酸形成的二肽:H2NCH2CONHCH(CH3)COOH可简单表示为:甘·丙;以上图中汉字均表示某种氨基酸的简称,其中鸟为鸟氨酸,是一种罕见的氨基酸,结构简式为H2N(CH2)3CHNH2COOH。下列说法不正确的是( )
A.短杆菌肽S可看作环十肽
B.短杆菌肽S含有十个肽键
C.鸟氨酸既可与酸反应也可与碱反应
D.短杆菌肽S在某种蛋白酶体作用下生成一系列产物中只有三肽,这些三肽最多有二种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com