
题目列表(包括答案和解析)
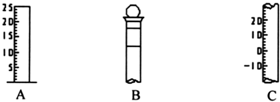 Ⅰ.如图所示为常见仪器的部分结构.
Ⅰ.如图所示为常见仪器的部分结构.| 54b |
| 102a |
| 54b |
| 102a |
(13分)(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸检验Cl2的性质 ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
(3)卤素单质F2、Cl2、Br2、I2的熔沸点由高到低排列为 ,理由是 ;
卤化氢HF、HCl、HBr、HI中,沸点最低为 ,最高为 ,造成的原因为 。
(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸检验Cl2的性质 ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com