
题目列表(包括答案和解析)
 H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4 H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。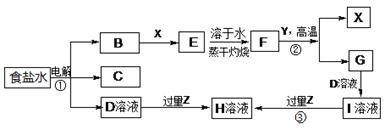
已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com