
题目列表(包括答案和解析)
下列物质中有氧离子的是
A、氧化镁 B、一氧化氮 C、氯酸钾 D、磷酸
A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置 ,
(2)写出阴离子B22-的电子式(用B对应元素的元素符号来表示) 。
(3)常温下,X、Y的水溶液pH均为4,设X、Y水溶液中由水电离出的OH-浓度分别为
a、b,则a与b之比为 。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 。
(5)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的化合物的稀溶液中构成
原电池,则负极的电极反应式为 。
(6)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等
体积pH=b的X的水溶液,且a+b=14,充分作用后,该溶液中各种离子浓度由大到小的顺序为 。
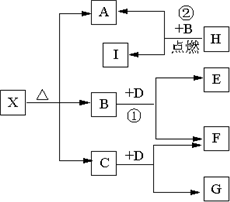 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
 2MgO+C
2MgO+C 2MgO+C
2MgO+C
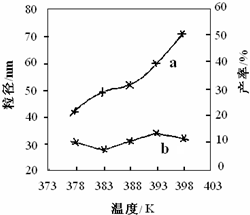
| 实验 编号 | T/K | 反应 时间/h | 反应物的物质的量配比 n[CO(NH2)2]:n[MgCl2?6H2O] | 实验目的 |
| ① | 378 | 3 | 3:1 | (Ⅰ)实验①和③探究______ ______; (Ⅱ)实验②和④探究______; (Ⅲ)实验②和______探究反应时间对产率的影响. |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
(Ⅰ)现有下列五种物质
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素,请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_________;应用最广泛的抗生素之一的是________;既可作为调味剂,又可作为防腐剂的是_________;食用过多会引起血压升高、肾脏受损的是_________。
(Ⅱ)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
(1)抗酸药物具有抗酸作用的原因是__________________________。
(2)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:
__________________________、__________________________。
②淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com