
题目列表(包括答案和解析)
离子键、共价键、和范德华力是构成物微粒之间的不同作用力。下列物质中只含有上述一种作用力的是
A、冰 B、氯化钠 C、氢氧化钠 D、碘
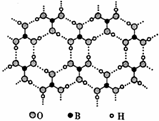 (2011?福建模拟)[化学--物质结构与性质]
(2011?福建模拟)[化学--物质结构与性质]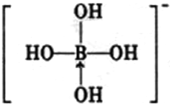 或
或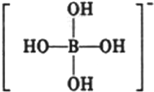
 或
或
| BF4- | BF3 | |
| 键长/pm | 152 | 130 |
| H | + 4 |
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com