目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境.这种环境系统中普遍存在铁硫簇结构,如Fe
2S
2、Fe
4S
4、Fe
8S
7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
[实验I]硫的质量确定:
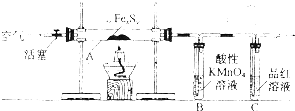
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL 0.1mol?L
-1的酸性KMnO
4溶液,在试管C中加入品红溶液.通入空气并加热,发现固体逐渐转变为红棕色.待固体完全转化后将B中溶液转移至250mL容量瓶,洗涤试管B后定容.取25.00mL该溶液用0.01mol?L
-1的草酸(H
2C
2O
4)进行测定剩余KMnO
4溶被浓度的滴定.记录数据如下:
| 滴定次数 |
待测溶液体积/mL |
草酸溶液体积/mL |
| 滴定前刻度 |
滴定后刻度 |
| 1 |
25.00 |
1.50 |
23.70 |
| 2 |
25.00 |
1.02 |
26.03 |
| 3 |
25.00 |
0.00 |
24.99 |
相关反应:①2MnO
4+2H
2O+5SO
2=2Mn
2++5SO
42-+4H
+②2MnO
4+6H
++5H
2C
2O
4=2Mn
2++10CO
2↑+8H
2O
[实验Ⅱ]铁的质量确定:
将实验I硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体.
试回答下列问题:
(1)检查“实验I”中装置气密性的方法是
.
(2)滴定终点的判断方法是
.
(3)试管C中品红溶液的作用是
.有同学提出,撤去C装置,对实验没有影响,你的看法是
(选填“同意”或“不同意”),理由是
.
(4)根据实验I和实验II中的数据可确定该铁硫簇结构的化学式为
.
[问题探究]滴定过程中发现,细心的小明发现该KMnO
4颜色褪去的速率较平常滴定时要快的多.为研究快的原因.甲同学继续进行了下列实验,实验数据如下表:
| 编号 |
温度/℃ |
酸化的H2C2O4溶液/mL |
KMnO4溶液/mL |
溶液褪色时间/s |
| 1 |
25 |
5.0 |
2.0 |
40 |
| 2 |
25 |
5.0
(另加少量可溶于水MnSO4粉末) |
2.0 |
4 |
| 3 |
60 |
5.0 |
2.0 |
25 |
(5)分析上进数据,滴定过程中反应速率较快的一种可能原因是
.

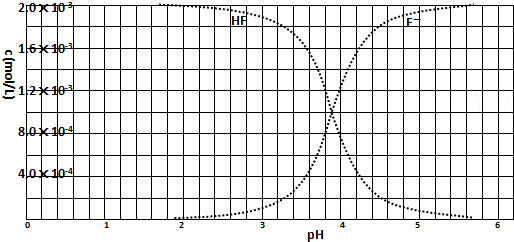
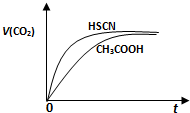
 (2010?浙江)已知:
(2010?浙江)已知:
