
题目列表(包括答案和解析)
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以有效降低NaNO2的含量 |
(13分)
(1)某化学兴趣小组在用稀硫酸与纯锌粒制取氢气时发现反应速率较慢,为了加快该反应速率,他们进行了多项探究,针对他们的探究回答下列问题:
①他们进行的下列探究中不能达到实验目的的是____________________(填选项)
A.升高反应温度 B.适当增加硫酸的浓度 C.加水 D.把锌粒改用锌粉
②他们探究中还发现加入少量硫酸铜溶液也可加快氢气的生成速率。你认为原因是;
____________________________________________________________ 。
上述实验中除发生反应Zn+H2SO4=ZnSO4+H2↑,还发生了____________________(填离子反应方程式)
③他们分析后认为下列某一物质溶液也有类似硫酸铜的作用,你认为是______________(填选项)
A.Na2SO4 B.Ag2SO4 C.MgSO4 D.K2SO4
(2)根据你所学的有关实验,填写下列空白。
④在实验室制取乙酸乙酯时,加入碎瓷片的作用是____________________。
⑤石蜡油高温分解实验中,加入碎瓷片主要起____________________作用。
⑥在实验室制取乙酸乙酯时,将制得的乙酸乙酯蒸汽导入____________________ ,以达到除去杂质和收集产物的目的。
⑦设计一个比较醋酸与碳酸酸性强弱的实验____________________。(用离子方程式表示)
(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
 据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]
据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]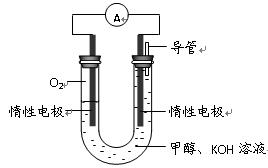
(8分)2009年9月8日,中国卫生部部长陈竺表示,中国甲型H1N1流感疫苗接种方案的原则已经确立:要首先保护最为易感和脆弱的人群,特别是中学生、有基础性疾病(如糖尿病)的人、一线的公共服务人员。请根据这一主题和题意回答下列问题。(用下列选项的字母代号填空)
A.蛋白质 B.强氧化性 C.葡萄糖 D.变性
E.强酸性 F.淀粉 G.盐析 H.强还原性
(1)糖尿病是因为病人的尿液中含 而得名的。
(2)甲型H1N1流感病毒和疫苗都含有 。
(3)为预防甲型H1Nl流感.可用具有 性的NaClO溶液进行环境消毒。
(4)烹制猪肉时温度达到71℃,就可杀死细菌和病毒。这是因为细菌和病毒发生了 。
(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
ΔH2
CH3OH(g) + H2O(g)
ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
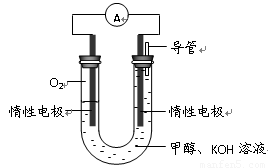
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com