
题目列表(包括答案和解析)
某化学兴趣小组以“溶液的酸碱度及其应用”为题,开展研究性学习(C),请你作为该小组成员来解决以下问题:
(1)某同学说“酸溶液呈酸性,碱溶液呈碱性,则盐溶液一定呈中性”.你认为这种推理________(填“正确”或“不正确”);
(2)从某工厂排出的废水中取出A、B两份水样,经测定,A水样的pH为4.8,B水样的pH为10.2,则A水样呈________性,B水样呈________性,A、B两份水样都对环境有污染,请设计一个实验方案帮助该工厂治理污水;
(3)氢氧化钠溶液和稀盐酸反应,无明显现象发生,请你设计一个实验,能通过清晰可见的现象,控制它们在恰好完全反应时停止实验.
某化学兴趣小组以“溶液的酸碱度及其应用”为题,开展研究性学习(C),请你作为该小组成员来解决以下问题:
(1)某同学说“酸溶液呈酸性,碱溶液呈碱性,则盐溶液一定呈中性”.你认为这种推理________(填“正确”或“不正确”);
(2)从某工厂排出的废水中取出A、B两份水样,经测定,A水样的pH为4.8,B水样的pH为10.2,则A水样呈________性,B水样呈________性,A、B两份水样都对环境有污染,请设计一个实验方案帮助该工厂治理污水;
(3)氢氧化钠溶液和稀盐酸反应,无明显现象发生,请你设计一个实验,能通过清晰可见的现象,控制它们在恰好完全反应时停止实验.
(1)为较准确地测定河水样品的酸碱度,你建议使用________(填序号)。
A.紫色石蕊试液 B.蓝色石蕊试液
C.无色酚酞试液 D.pH试纸
(2)通过网上查询,得知用于测定磷含量的试剂是钼酸铵[化学式为(NH4)2MoO4],其中钼酸铵中钼元素的化合价是________。
(3)以下几种研究方案中,你认为不恰当的是________(填序号)。
A.请教专家、老师后,进行氮、磷、钾等元素含量的测定
B.考虑到沿河建有硫酸厂,拟用氯化钡和稀硝酸检验河水中是否含有硫酸根离子
C.只到串场河上游取水样进行研究
D.调查沿河生活污水、工厂废水及化肥农药的使用情况
(4)研究报告里提出了以下设想,你认为不合理的是________(填序号)。
A.禁止沿河工厂将未处理的污水向河流中直接排放
B.城市生活污水要经处理净化达标后才能排放
C.指导农民科学合理地使用化肥、农药
D.在河流中投放化学试剂使氮、磷、钾等转化为不溶物沉降

(8分)某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题: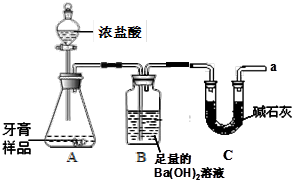
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com