
题目列表(包括答案和解析)
| 高温 |
| 高温 |
| c(Br-) |
| c(Cr-) |
| 高温 |
| 高温 |
| 高温 |
| 高温 |
| 光合作用 |
| 催化剂 |
| △ |
| ||
| △ |
| ||
| △ |
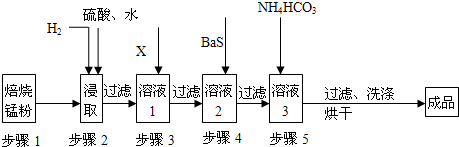
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2+ CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·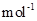 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
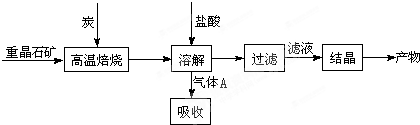
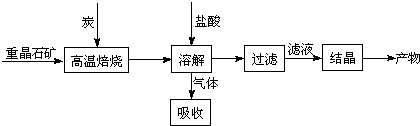
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
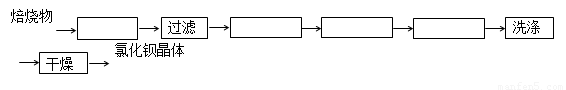
(方框内填写操作名称)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com