
题目列表(包括答案和解析)
氯气是一种非常重要的化工原料,含氯消毒剂在生产生活中有着广泛的用途。
(1)用氯气可制取“84消毒液”(有效成分为NaClO)。
①该制备反应的离子方程式为 。
②下列措施能增强“84消毒液”杀菌能力的是 。
A.加入适量醋酸
B.加入适量亚硫酸
C.加入少量NaOH粉末
③“84消毒液”不能对钢铁(含Fe、C)制品进行消毒,原因是 。
(2)二氧化氯(ClO2)是一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前,工业上开发出用电解法制取ClO2的新工艺,生产原理如图所示。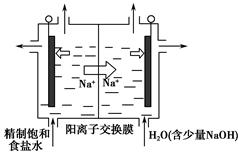
上述示意图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com