
题目列表(包括答案和解析)
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
| ||
| Ar |
| ||
| Ar |
(4分)工业上由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2 →(步骤Ⅰ)TiCl4 ![]() (步骤Ⅱ)Ti
(步骤Ⅱ)Ti
(1)写出步骤Ⅱ中TiCl4→Ti的化学反应方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ?mol-1。
工业上由金红石(TiO2)制取单质Ti,涉及的步骤为:
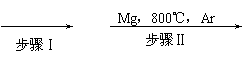
TiO2 TiCl4 Ti
(1)写出步骤ⅡTiCl4→Ti的化学方程式 。
(2)已知:①![]()
②![]()
③![]()
则反应![]() = kJ?mol-1
= kJ?mol-1
| Mg.800℃.Ar |
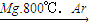 (步骤Ⅱ)Ti
(步骤Ⅱ)Ti湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com