
题目列表(包括答案和解析)
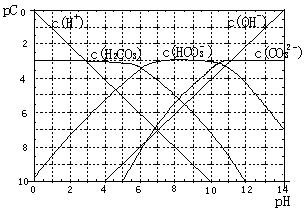 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为 。
(2)已知碳酸溶液中存在平衡:H2O+CO2 H2CO3
H2CO3![]() H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
。
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液。如浓度均为0.1mol·L-1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3- H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是 。
H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是 。
A.碳酸钠和氢氧化钠的混和溶液 B.醋酸和醋酸钠的混和溶液
C.硫酸和硫酸钠的混合溶液 D.氨水和氯化铵的混和溶液
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为 。
(2)已知碳酸溶液中存在平衡:H2O+CO2 H2CO3
H2CO3 H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
。
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液。如浓度均为0.1mol·L-1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3- H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是
。
H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是
。
A.碳酸钠和氢氧化钠的混和溶液 B.醋酸和醋酸钠的混和溶液
C.硫酸和硫酸钠的混合溶液 D.氨水和氯化铵的混和溶液
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ;ΔH>0
CH3COO-+H+ ;ΔH>0
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 ;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
 ④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化
的曲线是 ;
(3)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的
NaOH溶液Vb mL至溶液恰好呈中性,则Va Vb(填“>”、“<”或“=”)
假设质检部门规定市售醋酸浓度不得低于4.8g/100mL,某同学欲用中和滴定的方法来测定某品牌的食用醋中的醋酸含量是否达标。实验具体步骤如下:①托盘天平称取一定质量NaOH并配制成500mL NaOH溶液;②用已知浓度的盐酸标准溶液准确标定该NaOH溶液的浓度;③用上述已知准确浓度的NaOH溶液测定醋酸的浓度。
(4)不直接用配置的NaOH溶液滴定样品,而要用标准盐酸先标定再滴定的原因是 ;
(5)若实验过程如下:准确量取该食用醋20.00mL,置于250mL锥形瓶中,再滴加酚酞指示剂,用标定好的0.1000mol/L的NaOH溶液滴定,酚酞指示剂由 色恰好变成__________色且 即为终点。
重复滴定多次,结果记录如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(mL) | 19.40 | 15.10 | 14.90 | 15.00 |
则该食用醋中醋酸的物质的量浓度=________ mol·L-1,是否合格 (填”是”或”否”)
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 ;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25 ℃时,在 pH =5的稀醋酸溶液中,c(CH3COO-)= (填数字表达式);
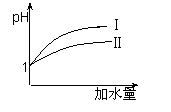 (3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化
的曲线是 ;
(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的
NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是
Va Vb(填“>”、“<”或“=”)。
(5)25 ℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时[NH4+]=a mol/L,
则[Cl-]=________。
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+)依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s)Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/LMgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com