
题目列表(包括答案和解析)
下列溶液中各微粒的浓度关系一定正确的是( )
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在: 、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH, pH的大小顺序是:④>③>①>② |
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO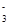 )+c(OH-)+c(CO )+c(OH-)+c(CO ) ) |
| D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1 |
(20分)(1) 25℃时,在酸性、碱性、中性溶液中,C(H+)·C(OH-)= 。
某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)= mol/L;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中C(OH-)= mol/ L,pH= .
L,pH= .
(2) 室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液 体积的变化),测得混合溶液的pH=6,试回答以下问题:
体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L-1
(3) 室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
下列溶液中各微粒的浓度关系一定正确的是( )
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在:
、Cl-、H+、OH-四种离子,溶液中一定存在:
c(Cl-)>c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH,
pH的大小顺序是:④>③>①>②
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO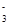 )+c(OH-)+c(CO
)+c(OH-)+c(CO )
)
D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1
已知在25℃时0.1mol/L醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中 正确(填“甲”或“乙”)
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的 (填写编号),然后测定溶液的pH。
A、固体CH3COOK B、固体CH3COONH4 C、气体NH3 D、固体NaHCO3
(3)若 (填“甲”或“乙”)的解释正确,溶液中的pH应 (填“增大”“减小”或“不变”)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是 。
③溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在: 、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH, pH的大小顺序是:④>③>①>② |
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO )+c(OH-)+c(CO )+c(OH-)+c(CO ) ) |
| D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com