
题目列表(包括答案和解析)
(13分)实验室用不含![]() 的
的![]() 溶液与不含
溶液与不含![]() 的
的![]() 溶液反应制备
溶液反应制备![]() 沉淀。
沉淀。
(1)用硫酸亚铁晶体配制上述![]() 溶液时,需加入硫酸和一种单质:___________,加入该单质的理由是:________________,加入硫酸溶液的目的是___________________。
溶液时,需加入硫酸和一种单质:___________,加入该单质的理由是:________________,加入硫酸溶液的目的是___________________。
(2)除去![]() 溶液中溶解的
溶液中溶解的![]() ,常采用的方法是____________________________。
,常采用的方法是____________________________。
(3)生成白色![]() 沉淀的操作是用长滴管吸取不含
沉淀的操作是用长滴管吸取不含![]() 的
的![]() 溶液,插入
溶液,插入![]() 溶液面下,再慢慢挤出
溶液面下,再慢慢挤出![]() ,这样操作的理由是 .
,这样操作的理由是 .
(4)制得的![]() 遇空气产生的现象是____________________________________,发生变化的化学方程式为_____________________________________。
遇空气产生的现象是____________________________________,发生变化的化学方程式为_____________________________________。
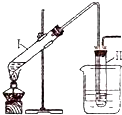 实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:| 实验步骤 | 实验操作 | 预期现象和结论 | ① | 取少量除杂后的溴乙烷于试管中, |
② | 取①中反应后的上层清液少量于另一支试管中, |
实验室用托盘天平等仪器配制500mL 1mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放人小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转人500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度l—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)计算需要NaCl晶体 g。
(2)实验操作步骤的正确顺序为(填序号)
(3)使用容量瓶前必须进行的一步操作是 。
(4)配制过程中,其他操作都正确,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒②容量瓶不干燥,含有少量蒸馏水③定容时俯视标线④定容时仰视标线⑤超过刻度线,吸出一部分水;⑥摇匀后液面下降,补充水。
(5)配制上述溶液需要用到的玻璃仪器是下图中的(填编号): 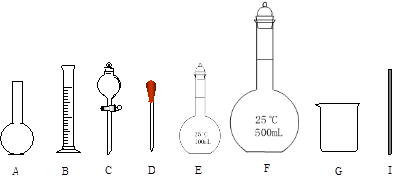
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
|
实验步骤 |
现象和结论 |
|
步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 |
现象: 结论:假设1不成立。 |
|
步骤2:
|
现象: 结论:假设2成立。 |
(3)测定空气中SO2含量的方法是:把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI 溶液25.00mL,则空气中的SO2含量为 mg/L。
(5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,10I—+2MnO4-+16H+=2Mn2++5I2+8H2O)
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com