
题目列表(包括答案和解析)
(10分)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________(填变大、变小、不变)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
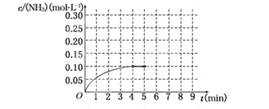
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(10分)在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____________其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
| A.2 mol X、1 mol Y、1 mol Ar |
| B.a mol Z、1 mol W |
| C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W |
| D.2 mol X、1 mol Y、1 mol Z |
(10分)在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2 溶液、Na2CO3 溶液、AgNO3溶液,为了鉴别各瓶试剂将它们分别编号为A、B、C、D两两混合,其实验现象为:
A+B→无色气体 B+C→白色沉淀 A+D→白色沉淀 A+C→无明显现象
(1)由此推断各试剂瓶中所盛试剂为(填化学式)
A: B: C: D:
(2)写出下列反应的离子方程式
①A+B: ②B+C: ③A+D:
(10分)在一次兴趣小组活动中,一小组同学利用物质间的互变,设计成一平面“魔方”如图所示。已知:
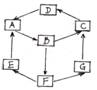
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体,B与硝酸银溶液反应生
成不溶于稀硝酸的沉淀;B也能将一种能形成酸雨的氧化物氧化
为F,F是一种含氧酸,且F的稀溶液能与A反应生成E和G。
③几种物质的部分物理性质为:
|
物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
依据以上信息填空。
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应化学方程式:A→B: ;
(3)写出下列反应的离子方程式:B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100ml18.5mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol·L-1,则气体的成分及体积比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com