
题目列表(包括答案和解析)
(8分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
(1)写出下列物质的化学式:
A:________,E:________,J:________,G:________. (2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:
______________________________________________________;
C转化为I的离子方程式:
(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4—, HSO4  H++SO42—。
H++SO42—。
请回答下列有关问题:
(1)Na2SO4溶液呈 填“弱酸性”、“中性”或“弱酸性”);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为 ;
(3)在0.10mol·L—1的Na2SO4溶液中,下列离子浓度关系正确的是 (填写编号)
| A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4) |
| B.c(OH—)=c(HSO4—)+c(H+) |
| C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)="2" c(SO42—)+2 c(HSO4—) |
(8分)化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全: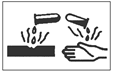
(1)在盛放浓硫酸的试剂瓶的标签上印有如右图所示警示标志,说明浓硫酸是一种________。
(2)下列有关实验操作和安全事故处理错误的有________。
a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底由下往上夹住距管口约处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石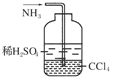
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用右图所示装置吸收氨气
(8分) 下图是实验室制备乙酸乙酯的实验装置。试回答:
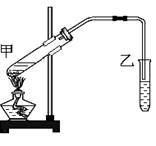
(1)试管甲中加入的试剂顺序是( )
A.乙醇、浓硫酸、乙酸
B.浓硫酸、乙醇、乙酸
C.浓硫酸、乙酸、乙醇
(2)甲处的试管内发生反应的化学方程式为:
(3)小试管乙中饱和Na2CO3的作用是( )
A、吸收乙醇
B、中和乙酸
C、增大溶液密度,降低乙酸乙酯在里面的溶解度
(4)乙装置中的导管未插入溶液的目的是 。
(8分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水分子的结构式 。
(2)全部由短周期元素组成的A、B、C三种物质,是中学化学常见的有色物质,它们均 能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。请写出A、B、C与水反应的化学方程式:
①A十 __________________
_______ __;
__________________
_______ __;
②B十 ;
;
③C十 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com