
题目列表(包括答案和解析)
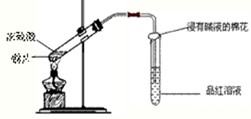 研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
| ||
| ||
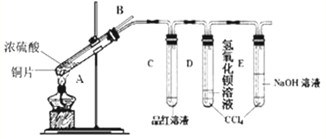
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
| 实验方案 | 现象 |
| 1取少量溶液于试管中,加入氢氧化钠溶液 | |
| 2取少量溶液于试管中,加入稀盐酸,加热,用湿润的蓝色石蕊试纸检验生成的气体. |
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
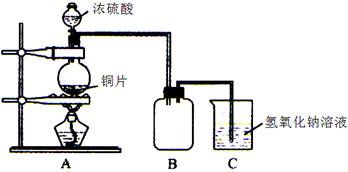
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式 。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是 (填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲、乙学生进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,在计算余酸的物质的量浓度。他认为测定二氧化硫的量的方法有多种,请问下列实验方案中可行的是 (填写编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案进行分析(可以不填满):
|
方案序号 |
分析 |
误差(偏低或偏高) |
改变措施 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是 。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)
。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲、乙学生进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,在计算余酸的物质的量浓度。他认为测定二氧化硫的量的方法有多种,请问下列实验方案中可行的是_______(填写编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案进行分析(可以不填满):
| 方案序号 | 分析 | 误差(偏低或偏高) | 改变措施 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)_____________________________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:
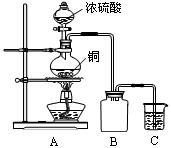
⑴B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
例某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:
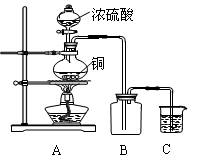
⑴B是用来收集实验中产生的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:
在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com