Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)

2NH
3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K
1、K
2的大小:K
1______K
2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是______(填序号).
A.2v(H
2)(正)=3v(NH
3)(逆) B.v(N
2)(正)=3v(H
2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N
2H
6Cl
2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH
4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式______.
②盐酸肼水溶液中离子浓度的排列顺序正确的是______(填序号).
A.c(Cl
-)>c(N
2H
62+)>c(H
+)>c(OH
-)
B.c(Cl
-)>c>c(H
+)>c(OH
-)
C.c(N
2H
62+)+c+c(H
+)=c(Cl
-)+c(OH
-)
D.c(N
2H
62+)>c(Cl
-)>c(H
+)>c(OH
-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb
4+具有很强的氧化性.水中铅的存在形态主要有Pb
2+、Pb(OH)
+、Pb(OH)
2(在水中溶解度小)、Pb(OH)
3-、Pb(OH)
42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:

(1)Pb(NO
3)
2溶液中,c(Pb
2+)/c(NO
3-)______1/2(填“>”、“=”、“<”).
(2)向Pb(NO
3)
2溶液滴加盐酸,溶液中c(Pb
2+)/c(NO
3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为______.
(3)向Pb(NO
3)
2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为______ 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清.pH=13时,混合体系中发生的主要反应的离子方程式为:______.

 2NH3(g)
2NH3(g)
 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g) 下列问题:
下列问题: 度的排列顺序正确的是 (填序号)。
度的排列顺序正确的是 (填序号)。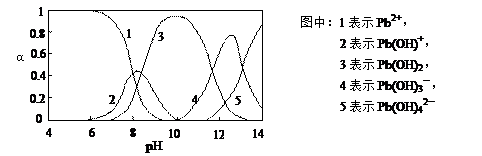
 。
。