
题目列表(包括答案和解析)
| A、4 | B、2 | C、1 | D、无法确定 |
PH=2的盐酸和PH=2的硫酸等体积混合,不计体积和温度的变化,则混合溶液中c(H+)的数值为( )
A、0.2×10-2mol/L B、1×10-2mol/L
C、2×10-2mol/L D、1.5×10-2mol/L
pH=5的盐酸和pH=3的硫酸等体积混合后溶液的pH为
[ ]
pH=5的盐酸和pH=3的硫酸等体积混合后溶液的pH为
[ ]
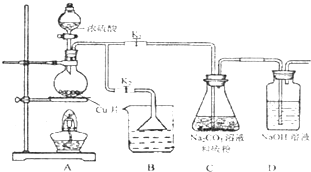 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com