
题目列表(包括答案和解析)
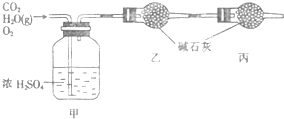 已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).
已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com