化学科研小组的同学在精确测试Na
2SO
3溶液的pH时,遇到了困惑.为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你了解情况,参与交流讨论.
[查阅资料]①常温下0.1mol?L
-1的H
2SO
3溶液的pH约为2.1.
②通常情况下,H
2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L
-1的H
2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na
2SO
3?7H
2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na
2SO
3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na
2SO
3?7H
2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行
4
4
次.
(2)给Na
2SO
3?7H
2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明.
避免Na2SO3被氧化,2Na2SO3+O2=2Na2SO4
避免Na2SO3被氧化,2Na2SO3+O2=2Na2SO4
.
(3)猜想Na
2SO
3在高温强热下发生分解反应的化学方程式是
.
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强
.实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示)
S
2-+H
2O

HS
-+OH
-S
2-+H
2O

HS
-+OH
-.
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论.
取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
、
另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-
另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-
.

 HS-+OH-
HS-+OH- HS-+OH-
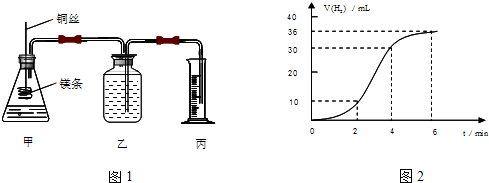
HS-+OH- 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.