I.某化学兴趣小组的同学进行Cl
2、NH
3的制备及性质检验等实验的流程和部分装置如图1:

①利用A、G装置设计一个简单的实验验证Cl
2、Fe
3+、I
2的氧化性强弱为Cl
2>Fe
3+>I
2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
,试剂M为
FeI2
FeI2
溶液,证明氧化性为Cl
2>Fe
3+>I
2的实验现象是
先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
.
②已知3Cl
2+2NH
3═6HCl+N
2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
黄绿色气体消失,产生白烟
黄绿色气体消失,产生白烟
,反应一段时间后,关闭b打开c,观察到的现象为
烧杯中的液体进入烧瓶中,形成喷泉
烧杯中的液体进入烧瓶中,形成喷泉
.
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.
②使用补全仪器后的装置进行实验,取50mL 0.30mol/L H
2SO
4溶液与50mL 0.65mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm
3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=
-55.7kJ?mol-1
-55.7kJ?mol-1
,
③实验中若用60mL0.30mol?L
-1H
2SO
4溶液跟50mL0.65mol?L
-1NaOH溶液进行反应,与上述实验相比,所求中和热
相等
相等
(填“相等”、“不相等”);若用50mL0.60mol?L
-1醋酸代替H
2SO
4溶液进行上述实验,测得反应前后温度的变化值会
偏小
偏小
(填“偏大”、“偏小”、“不受影响”).

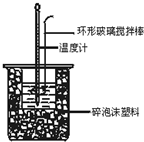 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )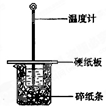 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )