近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。已知
① 2CH
4 (g) + 3O
2 (g) =2CO (g) + 4H
2O(l) △H1 = -1214.6 KJ/mol
② 2CO (g) + O
2(g) = 2CO
2 (g) ΔH2 = -566 kJ/mol
则反应CH
4(g) + 2O
2 (g) = CO
2(g) + 2H
2O (l) 的△H =_____________。
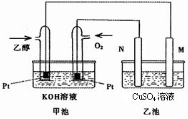
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH
4和O
2,构成甲烷燃料电池。通入CH
4的一极,其电极反应式是:CH
4 + 10OH
-― 8e
-=CO
32-+ 7H
2O;通入O
2的一极,其电极反应式是________________________。
(3)若用石墨做电极电解500ml饱和食盐水,写出电解反应的离子方程式为:__________________;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH=______________________。
(4)将不同量的CO(g) 和H
2O(g) 分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g) +H
2O(g)

CO
2(g) +H
2(g),得到如下三组数据


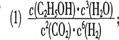
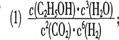
 CO2(g) +H2(g),得到如下三组数据
CO2(g) +H2(g),得到如下三组数据