
题目列表(包括答案和解析)
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 56 |
| b |
| 22.4 |
| a |
| 56 |
| b |
| 22.4 |
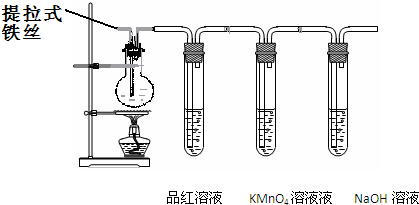
某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在烧瓶中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热烧瓶至有较多量气体产生时停止加热,品红试液颜色褪去烧瓶中溶液变为棕黄色。④一段时间后KMnO4/H+颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体。烧瓶中液体变为浅绿色。根据以上实验回答:

(1)在步骤②中现象说明 ;
(2)在步骤③中,品红褪色的原因是 ;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方程式表示) ; ;
(4)设计实验证明反应后的溶液中有Fe2+: 。

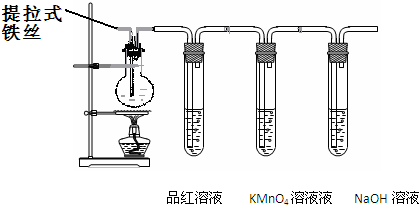
某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在试管a中加入80%的H2SO4;②将螺旋状铁丝插入H2SO4溶液中,观察到先有少量气泡,后气泡消失的现象;③加热试管a至有较多气体产生时停止加热,品红试液颜色褪去,试管a中溶液变为棕黄色;④一段时间后KMnO4(H+)颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体,试管中液体变为浅绿色。请回答下列问题:

(1)在步骤②中现象说明____________________。
(2)在步骤③中,品红褪色的原因是___________。
(3)写出步骤④中使溶液变为浅绿色可能的原因:_________;_________(用离子方程式表示)。
(4)设计实验证明反应后的溶液中含有Fe2+:_____
_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com