
题目列表(包括答案和解析)
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
 2NH3(g) △H=-192.0kJ·mol-1
2NH3(g) △H=-192.0kJ·mol-1 
 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。 科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)=2NH3(g)+![]() O2(g) ΔH=+765.2kJ?mol-1
O2(g) ΔH=+765.2kJ?mol-1
回答下列问题:
(1)画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
高其反应速率且增大NH3生成量的建议: 。
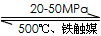
(3)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0L的密
2NH3(g)。设在容积为2.0L的密
闭容器中充入0.60mol N2(g)和1.60 mol H2(g).反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 。计算
。计算
① 该条件下N2的平衡转化率;
②该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l) ![]() 2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H =-285.8 kJ・mol-1;
CO(g) : △H =-283.0 kJ・mol-1;
CH4(g) :△H =-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 O2(g)△H=+765.2kJ?mol-1
O2(g)△H=+765.2kJ?mol-1 .计算
.计算湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com