随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO
2的含量及有效地开发利用CO
2,引起了普遍的重视.
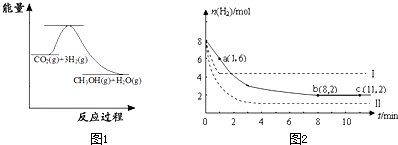
(1)目前工业上有一种方法是用CO
2来生产甲醇:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol
-1)的变化.该反应是
放热
放热
(填“吸热”或“放热”)反应.
(2)某温度下,若将6mol CO
2和8mol H
2充入2L的密闭容器中,测得H
2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H
2)=
1mol/(L?min)
1mol/(L?min)
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H
2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
升高温度
升高温度
,曲线Ⅱ改变的实验条件是
增大压强
增大压强
.
(3)下列各项中,不能够说明CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)已达到平衡的是
D
D
(填选项).
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH
3OH分解的速率和CH
3OH生成的速率相等
C.一定条件下,H
2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO
2,同时生成1mol CH
3OH.

