
题目列表(包括答案和解析)
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3﹣ |
Cl﹣ |
|
浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g)
2NO(g) 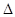 H>0
H>0| 3 |
| 2 |
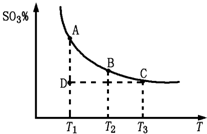
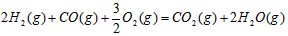
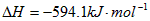 。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_____________________;
。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_____________________;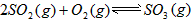 ,平衡混合体系中SO3的百分含量和温度的关系如图所示。 根据图示回答下列问题:
,平衡混合体系中SO3的百分含量和温度的关系如图所示。 根据图示回答下列问题: 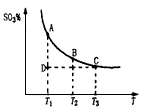
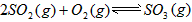 的△H_______0(填“>”或“<”);
的△H_______0(填“>”或“<”); 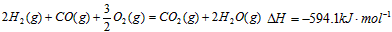 。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式____________________;
。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式____________________;  2SO3(g)平衡混合体系中SO3的百分含量和温度的关系如图所示。根据图示回答下列问题
2SO3(g)平衡混合体系中SO3的百分含量和温度的关系如图所示。根据图示回答下列问题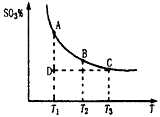
 2SO3(g)的△H_______0(填“>”或“<”);
2SO3(g)的△H_______0(填“>”或“<”);湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com