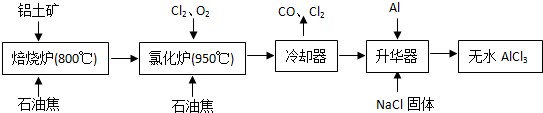
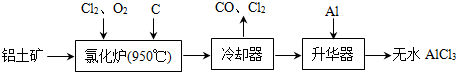
【化学-选修 化学与技术】
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔.
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是
.
(2)为了充分利用反应放出的热量,接触室中应安装
(填设备名称);吸引塔中填充许多瓷管,其作用是
.
(3)吸收塔排放的尾气中含有少量的SO
2,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用.
传统的方法是:尾气中的SO
2通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
,其优点是
.
创新方法是:将尾气中的SO
2用Na
2SO
3溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
,创新方法与传统方法相比,其优点是
.
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是
(填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO
2与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO
2的转化率
C.SO
2被氧化为SO
3时需要使用催化剂,这样可以提高SO
2的转化率
D.SO
3用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO
3吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气
m
3( O
2空气中的体积分数按20%计算).