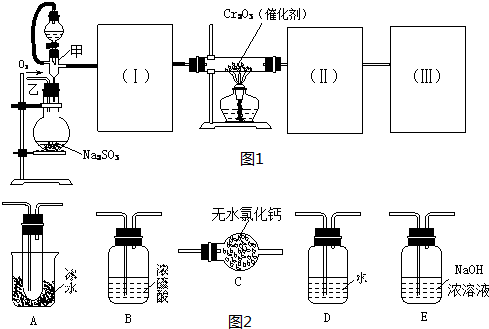
(2009?抚顺模拟)工业上生产硫酸时,利用催化氧化反应将SO
2转化为SO
3是一个关键步骤.压强及温度对SO
2转化率的影响如下表(原料气各成分的体积分数为:SO
2:7% O
2:11% N
2:82%);
压强/MPa
转化率/%
温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)已知SO
2的氧化是放热反应,如何利用表中数据推断此结论?
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
;
(2)在大400~500℃时,SO
2的催化氧化采用常压而不是高压,主要原因是:
增大压强对SO2的转化率影响不大,同时增大成本
增大压强对SO2的转化率影响不大,同时增大成本
;
(3)选择适宜的催化剂,是否可以提高SO
2的转化率?
否
否
(填“是”或“否”),是否可以增大该反应所放出的热量?
否
否
(填“是”或“否”);
(4)工业生产硫酸产生的尾气主要含SO
2和SO
3,会造成
酸雨
酸雨
(填环境问题),工业上常用足量的浓氨水来吸收,写出相关的离子方程式
2NH3?H2O+SO2=2NH4++SO32-+H2O
2NH3?H2O+SO2=2NH4++SO32-+H2O
2NH3?H2O+SO3=2NH4++SO42-+H2O
2NH3?H2O+SO3=2NH4++SO42-+H2O
(5)已知:2SO
2(g)+O
2(g)=2SO
3(g);△H=-196.9kJ?mol
-1,计算每生产1万吨98%硫酸所需要的SO
3质量和由SO
2生产这些SO
3所放出的热量.(写出解题过程)