
题目列表(包括答案和解析)
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。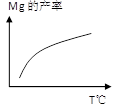
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
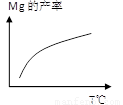
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g) 

| ||
| (一定条件) |
 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com