
题目列表(包括答案和解析)
(10分)在一定温度时向一个容积不变的容器中加入3 mol PCl3和4 mol Cl2使之反应
PCl3(g)+ Cl2(g) PCl5(g)
反应达到平衡时容器的压强为开始时的6/7,则此时。
PCl5(g)
反应达到平衡时容器的压强为开始时的6/7,则此时。
(1)容器的密度为开始时______倍;气体的平均相对分子质量为开始时______倍。
(2)保持恒温,将起始物改为a mol PCl3,b mol Cl2,c mol PCl5,欲使平衡时PCl5的体积分数1/6,则a、b、c(分别用含a、b和b、c的两个代数式表示)的关系为 、 。欲使反应向逆方向进行,a的取值范围 ;c的取值范围 。
(10分)在密闭容器里,通入x mol H2(g)和y molI2(g),发生反应
H2(g)+I2(g) 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ; (2)扩大容器的体积 ;
(3)充入更多的H2 ; (4)容器容积不变,通入氖气 ;
(10分)在25℃时,向100mL含氯化氢14.6g的盐酸溶液里放入5.60g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)氢气,在此之后,又经过4min,铁粉完全溶解,则:
(1)在前2min内用FeCl2表示的平均反应速率是____________
(2)在后4min内用HCl表示的平均反应速率是______________
(3)前2min与后4min相比,反应速率较快的是__________________________________,其原因是__________________________________________。
(4)反应结束后,溶液中Cl-的物质的量浓度为________________。
(10分)在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。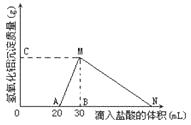
问:(1)此溶液中除含有AlO2- 外,还同时含有_ ___mol__ _ 离子;
(2)用离子方程式表示MN段发生的反应是
(3)原溶液中,c (AlO2-) 是 mol/L
(4)加盐酸到点N处,滴入的HCl溶液体积共为 ml
(10分)在短周期元素中:①金属性最强的元素是______,与水反应最剧烈的非金属是_____;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.
在11~18号的元素中,③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________,④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com