
题目列表(包括答案和解析)
某同学为了探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液,可能是什么物质,大胆猜想并设计实验进行验证。
[发现问题]当把黑色粉末与无色溶液混合时即产生气泡。[查阅资料]中学化学实验室常见的黑色粉末有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉等。
[提出假设]黑色粉末是 ,无色溶液是 。(只写一种假设)
[设计实验]
| 实验操作 | 实验现象 | 实验结论 |
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将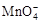 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4− +□C2O42−+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
|
滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
|
先滴入第1滴 |
60 s |
|
褪色后,再滴入第2滴 |
15 s |
|
褪色后,再滴入第3滴 |
3 s |
|
褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
[2012·东北哈师大附中、东北师大附中、辽宁省实验中学第二次联合模拟](16分)某同学为了探究铜与浓硫酸的反应,进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将铜丝向上提至离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操是 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:

(4)②中检验滤渣是否洗涤干净的实验方法是 。
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中可能有Cu2S
[2012·东北哈师大附中、东北师大附中、辽宁省实验中学第二次联合模拟](16分)某同学为了探究铜与浓硫酸的反应,进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将铜丝向上提至离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操是 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
(4)②中检验滤渣是否洗涤干净的实验方法是 。
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中可能有Cu2S |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com