
题目列表(包括答案和解析)

(1)A元素位于周期表中第________周期_________族。D的化学式_______________;X的电子式_______________。
(2)在反应①—⑥中,不属于氧化还原反应的是_______________(填编号)。
(3)往F溶液中加入NaOH溶液观察到的现象是_______________。
(4)已知反应⑥中消耗
(5)写出下列反应的离子方程式:
D的水溶液与小苏打溶液混合______________________________。
向含有3 mol F的溶液中通入4 mol Cl2的离子反应方程式为_______________________。
(20分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。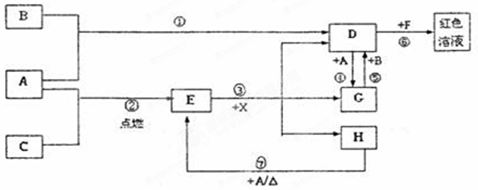
(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是:
(7)在D溶液中制备无水D的方法是:
(8)分别写出D溶液与小苏打溶液反应的离子方程式是:
(20分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是:
(7)在D溶液中制备无水D的方法是:
(8)分别写出D溶液与小苏打溶液反应的离子方程式是:
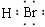
(1)A元素位于周期表中第________周期________族。D的化学式___________;X的电子式______________。
(2)在反应①—⑥中,不属于氧化还原反应的是______________(填编号)。
(3)往F溶液中加入NaOH溶液观察到的现象是______________。
(4)已知反应⑥中消耗
(5)写出下列反应的离子方程式:
D的水溶液与小苏打溶液混合____________________________。
向含有3 mol F的溶液中通入4 mol Cl2的离子反应方程式为______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com