
题目列表(包括答案和解析)
大气为地球上各种生物的生存提供了条件。但是,随着工业和交通运输迅速发展,城市人口高度集中,人类向大气中大量排放烟尘和有害气体等,正在对大气造成污染。我国某工业城市的“空气质量日报”显示,该城市的空气受到一定程度的污染。某研究性学习小组对该城市的空气污染进行了下列研究:
(1)小组内一同学初步分析得出,该城市空气污染的主要原因有三个:A.使用石油液化气 B.燃烧含硫煤 C.粉尘污染。另一同学认为还有一个不可排除的原因是:D.
研究性学习小组就造成该城市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
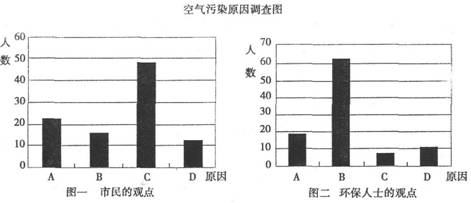
从环保人士的观点上分析,你认为造成该城市空气污染的主要有害成分是 (用化学式表示)。
(2)空气污染易形成酸雨。研究性学习小组对该城市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68。对此,你的合理解释是
(3)研究性学习小组同学取空气(含氮气、氧气、二氧化碳、二氧化硫等)10.0L(已折算成标准状况),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.0233g。试回答该白色沉淀的化学式为 ,通过计算得该空气中主要有害气体成分的体积分数为 。
(4)该小组同学提出下列措施以减少空气污染的主要有害成分排放量,你认为合理的是 (填序号)。
①用天然气代替煤炭作民用燃料 ②改进燃煤技术,减少煤的用量 ③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
(5)在容积均为1L(容积不可变)的甲、乙两个容器中,分别加入2molSO2、1molO2和4mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为![]() ,甲容器中平衡常数表达式为 ,此时
,甲容器中平衡常数表达式为 ,此时![]()
![]() (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用Na2CO3溶液处理过的口罩(湿润);⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
据报道,为防止罐中液氯再次泄漏,4月1日抢救人员将盛液氯的罐吊到事故发生地附近刚挖好的水塘中,用烧碱溶液处理。写出反应的离子方程式____________________________。
(2)用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代,生成含氯的有机化合物,对人体有害,世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱高效消毒剂二氧化氯(ClO2)。
我国最近研究成功了用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是______________,在H2SO4的酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,在以上反应中NaClO3和Na2SO3的物质的量之比为_______。
(3)一化学课外活动小组的同学制作了一种家用环保型消毒液发生器(如图1-3-3),用石墨作电极电解饱和氯化钠溶液,可制得少量消毒剂。为了研究各电极的产物,反应开始后沿玻璃管滴几滴酚酞试液到溶液中,发现上层溶液变红,一段时间后,红色消失。则与电源a端相连的电极上发生的电极反应式为____________________。

图1-3-3
该小组同学经查阅资料后认为褪色的原因可能有两个:一是氢氧化钠浓度过大;二是。小华设计了一个简单的实验,只需要一种试剂,便获得了有关褪色原因的结论,请简要写出小华设计的实验方案:______________________________________________________________。
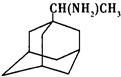 中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.
中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.
 )
)

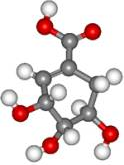
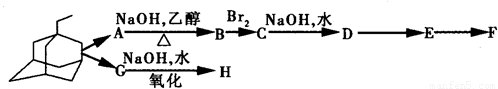
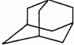 )
)

 S+2CO2
S+2CO2湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com