
题目列表(包括答案和解析)
工业制硫酸的核心反应是 :2SO2(g)+ O2(g)![]() 2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K= ,随着温度的升高,
上述平衡常数 (填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.11mol,O2为0.05mol,SO3为0.12mol。计算该条件下,反应的平衡常数K= 。
SO2的转化为SO3转化率= 。
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是
(填字母)。
A.通入氧气 B.移出氧气 C.增大压强
D.减小压强E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可先用氨水吸收,再用硫酸处理。
①反应的化学方程式为 ,
②这样处理的优点是
。
 2SO3(g) ΔH<0,回答下列问题:
2SO3(g) ΔH<0,回答下列问题:工业制硫酸的核心反应是:2SO2(g)+O2(g) 2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K=________,随着温度的升高,上述平衡常数________(填“增大”、“减小”或“不变”).
(2)将一定量的SO2(g)和O2(g)放入1 L密闭容器中,在一定条件下达到平衡,测得SO2为0.11 mol,O2为0.05 mol,SO3为0.12 mol.计算该条件下,反应的平衡常数K=________.
SO2的转化为SO3转化率=________.
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是________
(填字母).
A.通入氧气
B.移出氧气
C.增大压强
D.减小压强
E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2,可先用氨水吸收,再用硫酸处理.
①反应的化学方程式为________,
②这样处理的优点是________.
| 温度 溶解度 盐 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
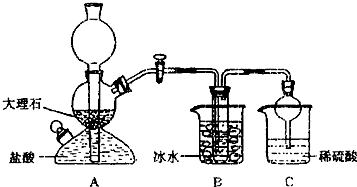
绿色化学的核心就是从源头上减少和消除工业生产对环境的污染.下列实验改动后符合绿色化学理念的是( )
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com