
题目列表(包括答案和解析)
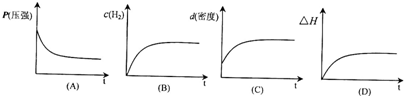
| [HCOO-] | [HCOOH]?[OH-] |
(8分)(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应: 的焓变为
。
的焓变为
。
(3)在一固定体积的密闭容器中,进行如下化学反应:
 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
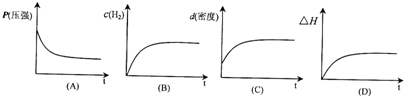
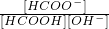 与稀释前比较______(填字母)
与稀释前比较______(填字母)(15分)(1)右图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中能量变化示意,请写出
过程中能量变化示意,请写出![]() 和
和![]() 反应的热化学方程式_________________________________。
反应的热化学方程式_________________________________。
(2)已知下列热化学方程式:
![]()
![]() =-393.5 kJ?mol-1
=-393.5 kJ?mol-1
![]()
![]() =-483.6 kJ?mol-1
=-483.6 kJ?mol-1
![]()
![]() =-283.0 kJ?mol-1
=-283.0 kJ?mol-1
由此可知反应:![]() 9
9![]() 的焓变为_________。
的焓变为_________。
 (3)某温度时
(3)某温度时![]() 在水中的沉淀溶解平衡曲线如同所示。(提示
在水中的沉淀溶解平衡曲线如同所示。(提示![]() ⇋
⇋![]() (aq)的平衡秆数
(aq)的平衡秆数![]() ?
?![]() ,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
A.加入![]() 可以使溶液由a点变到b点
可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无![]() 沉淀生成
沉淀生成
D.a点对应的![]() 等于c点对应的
等于c点对应的![]()
(4)在一固定体积的密闭容器中,进行如下化学反应:
![]()
![]() <0,其化学平衡常数K与t关系如下表:
<0,其化学平衡常数K与t关系如下表:
t/K | 298 | 398 | 498 | …… |
K/(mol?L | 4.1× | K | K | …… |
请完成下列问题:
①试比较K![]() 、K
、K![]() 的大小,K1_______K2(填写“>”“=”或“<”)
的大小,K1_______K2(填写“>”“=”或“<”)
②下列各项能作为判断浚反应达到化学平衡状态的依据的是__________(填字母序号)。
A.容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2 B.
的浓度之比为1:3:2 B. ![]()
C.容器内坼强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改蛮 E.混合气体中各成分的浓度不再改变
(8分)(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)己知下列热化学方程式:
由此可知反应: 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应: 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
| A.容器内N2、H2、NH3的浓度之比为1:3:2 |
| B.2v(正)(N2)=v(逆)(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com