
题目列表(包括答案和解析)
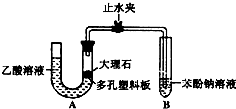 某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了如图的实验装置(夹持仪器已略去).进行了下述一些实验:
某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了如图的实验装置(夹持仪器已略去).进行了下述一些实验: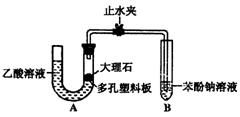 某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了右图的实验装置(夹持仪器已略去)。进行了
某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了右图的实验装置(夹持仪器已略去)。进行了
下述一些实验:
(1)某生检查装置A的气密性时,先关闭止水
夹,从左管向U型管内加水,至左管液面高于右
管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否? (填“正确”或“错误”)
(2)大理石与乙酸溶液反应的化学方程式为
(3)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(4)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,他的理由是 。改进该装置的方法是 。

| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com