
题目列表(包括答案和解析)
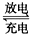 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 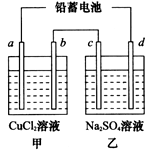
 H++A2-。
H++A2-。  CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol  CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol  2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。 研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.醋酸俗名冰醋酸,是食醋的主要成分
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解
平衡,试写出该物质的溶度积常数表达式Kap= 。
(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理
如图所示:
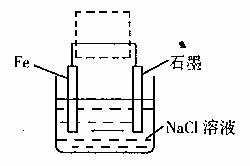
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。
③写出修改后石墨电极的电极反应式 。
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
合成氨工业对化学工业和国防工业具有重要意义。
(1)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
_______________________________________________________________
②氨水中水电离出的![]() (填写“>”、“<”或“=”)
(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为__________________。
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式___________________________;
②在标准状况下,每生成1mol B,转移电子的物质的量为_________mol。
(3)I 在某压强恒定的密闭容器中加入2mol N2和4 mol H2,发生如下反应:
N2(g)+3H2 (g)![]() NH3(g)
NH3(g)![]()
达到平衡时,体积为反应前的三分之二。求:
①达到平衡时,N2的转化率为_________。
②若向该容器中加入amol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
①_________②(填“>”、“<”或“=”)。
Ⅱ 若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。
③试比较平衡时NH3的浓度I_________Ⅱ (填“>”、“<”或“=”)。
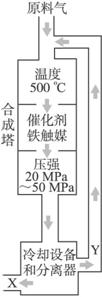
①X的化学式为______________;
②上图中条件选定的主要原因是(选填字母序号)__________;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)___________,当横坐标为温度时,变化趋势正确的是(选填字母序号)______________。
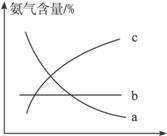
(2)常温下氨气极易溶于水,其水溶液可以导电。
④用方程式表示氨气溶于水且显弱碱性的过程:____________________________________;
⑤氨水中水电离出的c(OH-)_________10-7 mol·L-1(填写“>”“<”或“=”);
⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com