
题目列表(包括答案和解析)
瑞典皇家科学院2007年10月10日宣布,将本年度诺贝尔化学奖授予德国马普学会弗里茨一哈勃研究所的格哈德?埃特尔教授,以表彰他在固体表面化学过程研究领域做出开拓性成就。格哈德?埃特尔的重要贡献之一是对哈伯一博施法合氨反应催化机理的研究。格哈德?埃特尔建立的某温度下合成氨反应机理的各步反应的能量变化如图所示,图中的能量单位为kJ?mol-1。(注:图中“吸表示在催化剂表面的吸附)
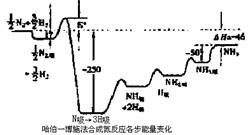
请回答下列问题:
(1)在合成氨反应中,决定反应速率的最主要的步骤是 (填字母)
A.氮分子解离为氢原子
B.氮原子的解离吸附
C.氢分子解离为氢原子
D.氨的解离吸附
(2)合成氨反应的机理为(用化学方程式表示)
① ;
②N2 ![]() N2吸
N2吸 ![]() 2N吸;
2N吸;
③ ;
④NH吸+H吸 ![]() NH3吸
NH3吸
⑤NH2吸+H吸![]() NH3吸
NH3吸 ![]() NH3
NH3
(3)某温度下合成氨反应的热化学方程式为 ;
(4)某温度下,合成氨反应Ke=3.0×103(mol?L-1)-2,该温度下,在体积恒定为10L的四个密闭容器中分别充入;(A)10mol、30mol H2和20molNH3(B)10molN2和30molH2(C)20molN2和60molH2(D)10molN2和28molH2(E)0.1molN2、0.3molH2和20MolNH3,则反应达到平衡后,N2的转化率最大的是 (填字母)。
(5)合成氨工业生产中所用的α―Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe3+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉。发生如下反应:2Fe2O3+C=4FeO+CO2,为制得该种活性最高的催化剂,应向480gFe2O3粉末加入炭粉的质量为 g.
 2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
2009年12月在哥本哈根召开的联合国气候变化大会上,“控制温室气体排放”成
为会议讨论的焦点问题,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普
遍重视。
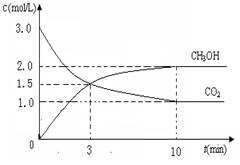
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探
究反应原理,现进行如下实验,在体积为1 L的密闭容器中,
充入3mol CO2和8mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)
②CO2的转化率为 。(保留一位小数)
③平衡常数K值为_____________;若升高温度K值将________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你
判断是否可行并说出理由:______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com