
题目列表(包括答案和解析)
(6分)在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
| C(H2)C(CO) |
| C(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
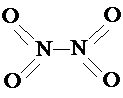 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列有关工业生产的叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可以提高N2、H2转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
E.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
20-2.(14分)海南省是海洋大省,海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
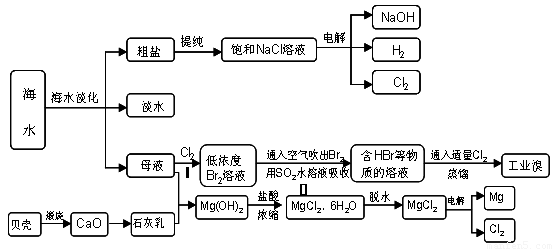
(1)请列举海水淡化的两种方法 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: 。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以
用做镁蒸气的冷却剂的是( )
A.H2 B.CO2
C.空气 D.O2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来
看,你认为该化工厂还可以再增加的生产项目的 。
(共6分)瑞典皇家 科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为_________。
(2)当催化剂中Fe2+与Fe3+物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_________(用小数表示)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:
2Fe2O3 +C  =4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
=4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com